CRISPR/Cas9作为一种新型的基因编辑技术,被广泛应用于多种物种的基因组编辑研究。由于低效率的同源重组修复及无法预期的编辑类型,CRISPR/Cas9技术多用于基因敲除的研究。目前,如何在细胞内高效且特异地引入单核苷酸突变成为基因编辑的重大研究方向。
CRISPR/nCas9/dCas9技术融合胞嘧啶脱氨酶的碱基编辑系统自研发以来被广泛关注,该系统不需要产生DSB和提供DNA模板就能有效地替代基因组中的特定碱基。碱基编辑器包含Cas9蛋白变体、胞嘧啶脱氨酶和尿嘧啶糖基化酶抑制剂(UGI)(图1)。
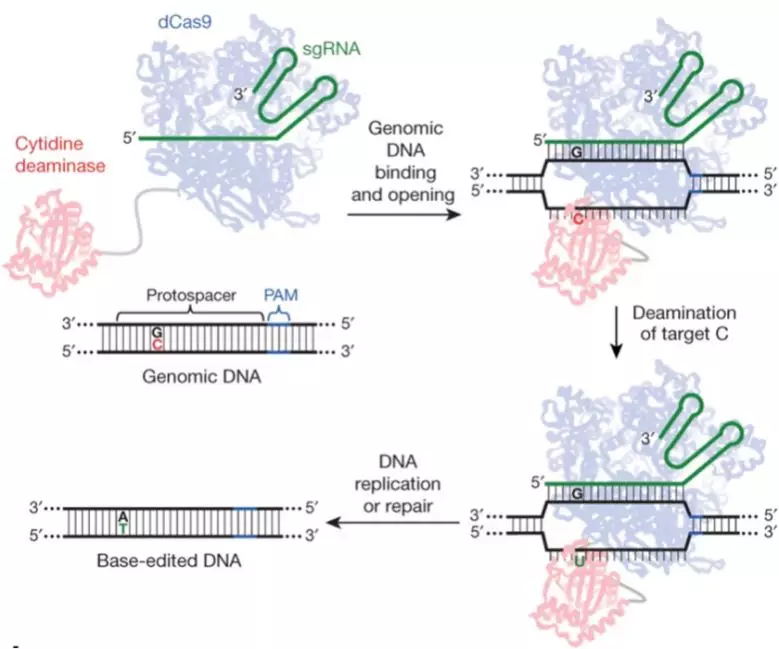
图1 单碱基编辑系统工作示意图
2019年5月22日,Plant Biotechnology Journal 杂志在线发表了yl6809永利棉花遗传改良团队题为"High Efficient and Precise Base Editing of C•G to T•A in the Allotetraploid Cotton (Gossypium hirsutum) Genome Using a Modified CRISPR/Cas9 System " 的研究论文,该论文利用Cas9缺口酶(nCas9),胞嘧啶脱氨酶(APOBEC1),尿嘧啶糖基化酶抑制剂(UGI)构建了适用于棉花遗传转化的碱基编辑系统(GhBE3)。实现了在棉花细胞内高效且特异地引入单核苷酸突变,具有很高的C•Gto T•A 的单碱基编辑效率,并且可以进行稳定的遗传转化。

在此之前,华中农大棉花团队已经发表了3篇yl6809永利棉花基因编辑的研究论文,系统的对棉花中不同方式的基因编辑进行了研究:2017年发表的"High efficient multi-sites genome editing in allotetraploid cotton (Gossypium hirsutum ) using CRISPR/Cas9system"论文中,介绍了国际上最早的棉花编辑系统之一,该系统使用了棉花內源的U6启动子和合适的抗生素筛选标记,使得CRISPR/Cas9技术在异源四倍体棉花中的应用具有高效特异的编辑;2018年发表了"Whole genome sequencing reveals rare off-target mutations and considerable inherent genetic or/and somaclonal variations in CRISPR/Cas9-edited cotton plants",该论文利用高通量测序的方法,揭示了在CRISPR/Cas9编辑的棉花植株中,脱靶突变很少,更多地是受体材料固有遗传或/和体细胞无性系变异;2019年发表了Robust CRISPR/Cpf1 ( Cas12a ) mediated genome editing in allotetraploid cotton ( G.hirsutum ) "的研究论文,该论文分析了Cpf1( Cas12a ) 蛋白在棉花异源四倍体中的编辑作用,具有很高的编辑效率,并且没有发现脱靶效应。
在本研究中,作者利用Cas9缺口酶(nCas9),胞嘧啶脱氨酶(APOBEC1),尿嘧啶糖基化酶抑制剂(UGI)构建了适用于棉花遗传转化的碱基编辑系统(GhBE3)。选择两个内源基因(GhCLA,GhPEBP),设计了三个靶标(sgRNA1,sgRNA2靶向GhCLA基因,sgRNA3靶向GhPEBP基因),构建单碱基编辑载体并通过农杆菌介导进行棉花遗传转化。发现在棉花中靶标基因GhCLA,GhPEBP的三个靶标均被编辑,而且C-T的编辑效率达到57.78%,以靶标位点上多个C位点同时编辑为主;该系统在靶标序列上的“编辑窗口”为6个碱基(PAM序列远端5'端3- 8的位置),且“编辑窗口”内C-T替换效率在总DNA序列中达到18.63%,靶标序列编辑窗口内的C-T编辑效率远高于其余部位C-T替换的效率(图2)。
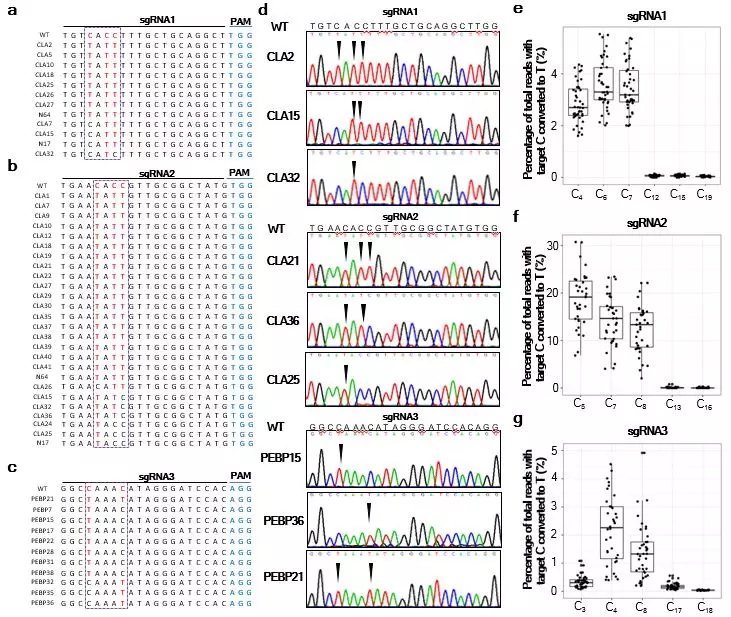
图2 GhCLA和GhPEBP基因靶标位点编辑检测及窗口内位点的突变检测
利用深测序检测27个潜在脱靶位点,在潜在脱靶位点的编辑窗口内发生C-T替换比例均低于0.1%,统计分析后碱基编辑的植株和野生植株没有脱靶效率的差异。此外,将两个GhCLA基因编辑的单株和一个野生(Jin668)植株进行100×深度的全基因组测序以检测脱靶效应。在从全基因组水平预测的1500个潜在脱靶位点上没有发现脱靶突变,这表明单碱基编辑系统对棉花的基因组编辑具有较强的特异性(图3)。
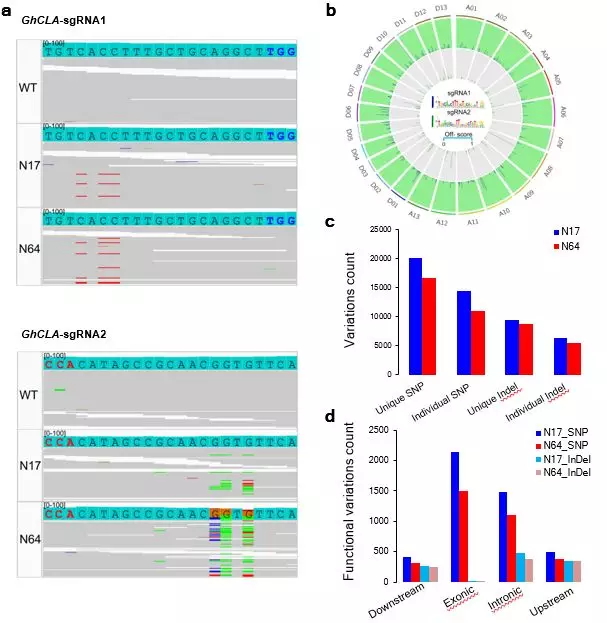
图3 GhBE3系统在棉花中的全基因组测序
该单碱基编辑系统系统在异源四倍体棉花中首次应用,具有较高的C•Gto T•A 的单碱基编辑效率和特异性,它将成为棉花功能基因组研究新的重要的技术手段。
yl6809永利作物遗传改良国家重点实验室金双侠教授为该论文的通讯作者,已毕业的硕士秦雷为第一作者,张献龙教授也参与了这项工作。该研究受到国家重点研发计划(2016YFD0100203-9 ) 和科技部转基因植物研究与产业化专项(2016ZX08010001-006 ) 和中央高校科研经费(2013PY064,2662015PY028,2662015PY091 和0900206328) 的支持。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1111/pbi.13168


